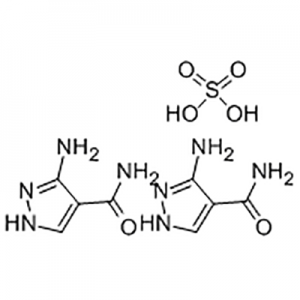
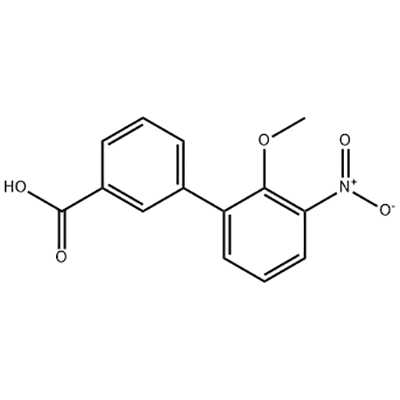
2'-metoxý-3'-nítró-bífenýl-3-karboxýlsýra
2'-metoxý-3'-nítró-bífenýl-3-karboxýlsýra
2'-Metoxý-3'-nítró-bífenýl-3-karboxýlsýra er notuð sem milliefni Eltrombopag.
Eltrombopag, þróað af GlaxoSmithKline (GSK) í Bretlandi og síðar þróað í sameiningu með Novartis í Sviss, er fyrsti og eini viðurkenndur lítill sameinda non-peptíð TPO viðtakaörvi í heiminum.Eltrombopag var samþykkt af bandaríska matvæla- og lyfjaeftirlitinu árið 2008 til að meðhöndla sjálfvakinn blóðflagnafæð purpura (ITP) og árið 2014 til meðferðar á alvarlegu vanmyndunarblóðleysi (AA).Það er einnig fyrsta lyfið sem bandaríska FDA hefur samþykkt til meðferðar á AA undanfarin 30 ár.
Í desember 2012 samþykkti bandaríska matvælastofnunin Eltrombopag til að meðhöndla blóðflagnafæð hjá sjúklingum með langvinna lifrarbólgu C (CHC), þannig að lifrarbólgu C sjúklingar með slæmar horfur vegna lágs blóðflagnafjölda geta hafið og viðhaldið stöðluðu interferónmeðferð við lifrarsjúkdómum.Þann 3. febrúar 2014 tilkynnti GlaxoSmithKline að Matvæla- og lyfjaeftirlitið veitti byltingarkennda lyfjaprófið Eltrombopag til að meðhöndla blóðfæð hjá sjúklingum með alvarlegt efnisblóðleysi (SAA) sem svöruðu ekki ónæmismeðferð að fullu.Þann 24. ágúst 2015 samþykkti bandaríska matvælastofnunin Eltrombopag til meðferðar á blóðflagnafæð hjá fullorðnum og börnum 1 árs og eldri með langvarandi ónæmisblóðflagnafæð (ITP) sem hafa ófullnægjandi svörun við barksterum, immúnóglóbúlínum eða miltistöku.Þann 4. janúar 2018 var Eltrombopag samþykkt til að vera skráð í Kína til að meðhöndla frumónæmisblóðflagnafæð (ITP).



![pentametýlen bis[1-(3,4-dímetoxýbensýl)-3,4-díhýdró-6,7-dímetoxý-1H-ísókínólín-2-própíónat], díoxalat](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin asetat; caspófúngín asetat; cancidas; kaspófúngín asetat [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)